Исследователи разработали новую технику редактирования генов, которая может полностью перестроить геном. Известная как «редактирование моста», она позволяет вызывать гораздо более значительные изменения, чем это возможно с помощью техники CRISPR, в частности, вставлять новые последовательности ДНК непосредственно в геном. Благодаря этому достигается уровень точности, недостижимый для современных методов редактирования.
Системы, управляемые РНК, произвели революцию в нашем понимании генома. Одной из таких систем является метод редактирования генов CRISPR, который работает как молекулярные «ножницы», управляемые направляющими РНК (гРНК). Помимо прочего, эта техника позволяет разрезать и изменять определенную генетическую последовательность, настраивая гРНК.
Весь процесс индуцируется белком CRISPR Cas. Термин Cas означает нуклеазу, которая связывается с короткой CRISPR РНК (crРНК), нацеленной на соответствующие последовательности ДНК или РНК. Эндонуклеазы Cas9 и Cas12 расщепляют ДНК, а Cas13 — РНК. Когда молекулярный инструмент расщепляет целевую последовательность, клетка систематически запускает процесс восстановления. Расщепление происходит многократно, пока клетка естественным образом не вызовет мутацию, вызвав ошибку репарации.
Однако, хотя метод CRISPR позволяет вызывать мутации в определенных местах, его уровень точности относительно ограничен. Она разрезает и повреждает целевые последовательности, чтобы инактивировать их, что делает ее скорее разрушительной, чем редактирующей техникой.
Чтобы исправить это, были предложены усовершенствованные версии CRISPR, позволяющие изменять целевые последовательности напрямую, а не полагаться на циклы восстановления-мутации. Некоторые из них позволяют модифицировать нуклеотидные основания, не проходя процесс расщепления, а другие преобразуют гРНК в ДНК и вставляют их в целевую последовательность. Однако и здесь точность остается ограниченной.
Команда из Института Арк, Калифорнийского университета в Беркли, Стэнфорда и Токио предлагает новый метод программируемого редактирования, позволяющий вставлять новые последовательности ДНК непосредственно в геном с помощью «РНК-мостов» — новой категории направляющих РНК. Это значительно повысит точность редактирования генов с помощью одной последовательности вставки.
«Система РНК-мостов — это принципиально новый механизм конструирования генома«, — объясняет главный исследователь исследования Патрик Хсу, профессор биоинженерии Калифорнийского университета в Беркли. «Мостовая рекомбинация может универсально изменять генетический материал путем вставки, вырезания, инверсии определенных последовательностей и т.д., что позволяет более эффективно редактировать живой геном, чем CRISPR«.
«РНК-мост»: универсальный адаптер, способный воздействовать на любую часть генома
Новая система молекулярного редактирования, обнаруженная в бактериях и археях, основана на последовательности вставки 110 (IS110). Это одна из большой группы транспозируемых последовательностей (или «прыгающих генов»), которые разрезают себя, перемещаются внутри генома и затем вставляют себя между двумя определенными нитями.
Эти короткие последовательности присутствуют в клетках всех живых организмов и в процессе эволюции превратились в настоящие инструменты для манипулирования ДНК. В частности, IS110 состоит из гена, кодирующего фермент рекомбиназу, который отвечает за генетическую рекомбинацию. Это процесс, который приводит к изменению физической связи между двумя сегментами ДНК.
Специалисты в новом исследовании, опубликованном в журнале Nature, использовали криоэлектронную микроскопию для изучения молекулярных структур комплекса РНК-мост-рекомбиназа. Они шаг за шагом продвигались от процесса расщепления IS110 к фазе рекомбинации.
Они обнаружили, что когда IS110 вырезается из генома, некодирующие концы нити ДНК соединяются, образуя две петли РНК-моста. Одна из петель связывается с IS110, а другая — с целевой нитью, куда будет вставлена новая последовательность, что делает РНК-мост первым примером биспецифической гРНК. Затем рекомбиназа индуцирует процесс вставки.
Более того, каждый РНК-мост является программируемым, поэтому можно объединить любую последовательность целевой и донорской ДНК. Другими словами, этот инструмент позволяет вставить любую последовательность ДНК в любое целевое геномное место. «Эти программируемые РНК-мосты отличают IS110 от других известных рекомбиназ, которые не содержат РНК-компонента и не могут быть запрограммированы«, — объясняет соавтор исследования Николя Перри, также сотрудник Института Арк и Калифорнийского университета. По аналогии, «это как если бы РНК-мост был универсальным адаптером питания, который делает IS110 совместимым с любой розеткой«, — отмечает он.
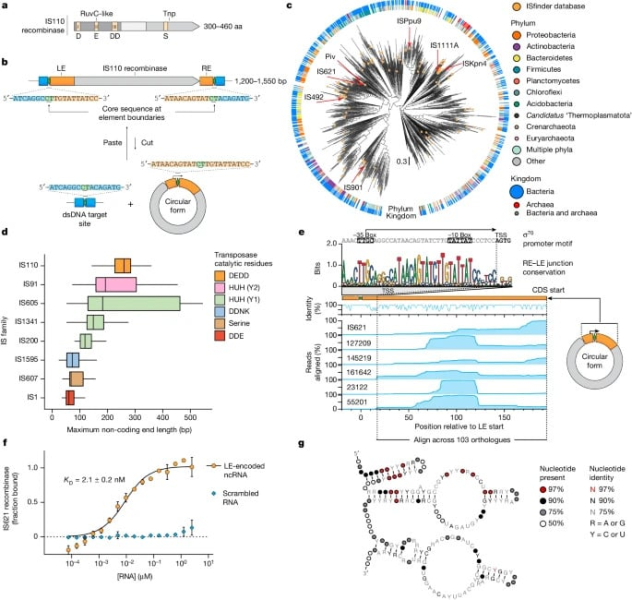
Мобильные генетические элементы IS110 экспрессируют (некодирующую) ncRNA, связанную кодируемой ими рекомбиназой. a, Схематическое изображение последовательности белка рекомбиназы IS110. b, Схематическое изображение структуры и жизненного цикла элемента IS110. c, Филогенетическое дерево с медианными корнями, построенное из 1 054 последовательностей рекомбиназы IS110. d, Распределение длин некодирующих концов по восьми семействам IS. e, График охвата РНК-секвенированием конкатенированных некодирующих концов IS621 и пяти родственных ортологов, экспрессированных с их эндогенного промотора бактерии E. coli. f, Представление флуоресцентно меченной рекомбиназы IS621 с дикого типа или скремблированной ncRNA для измерения равновесной константы диссоциации (KD). g, Консенсусная вторичная структура ncRNA, построенная из 103 последовательностей IS110.
Точность более 94 %
Этот механизм обеспечивает новой системе уровень точности, которого никогда не удавалось достичь с помощью техники CRISPR. В ходе испытаний на бактериях Escherichia coli команда продемонстрировала, что эффективность вставки определенного гена составляет более 60 %, а способность вставлять его в нужное место — более 94 %.
Более того, этот метод позволяет рекомбинировать две нити ДНК без высвобождения ранее расщепленных концов. Эти так называемые «шрамовые» последовательности являются существенным ограничением используемых в настоящее время методов редактирования генов.
Однако важно отметить, что данная методика пока была опробована только на бактериях, и ее эффективность на других типах клеток, включая человеческие, еще предстоит доказать. Тем не менее, в конечном итоге она может проложить путь к новым видам генной терапии. По словам экспертов, будущие исследования будут направлены на применение этого инструмента в клетках человека, повышение его точности и эффективности, а также изучение потенциальных дополнительных функций.
Видео с объяснением исследования:















