
Исследователи разработали соединение, которое действует как «молекулярный клей» для двух белков, которые, соединяясь, активируют естественный процесс самоуничтожения (или апоптоз) в раковых клетках. Эта стратегия отличается от других клеточных терапий как своей высокой специфичностью, так и способностью активировать молекулярный процесс, деактивированный раком. Соединение показало многообещающие результаты в испытаниях на клетках диффузной крупноклеточной В-лимфомы.
Ежедневно наш организм уничтожает около 60 миллиардов клеток с помощью процесса запрограммированной клеточной смерти, известного как апоптоз. Этот механизм необходим для естественного обновления клеток (в частности, клеток крови и кишечника) и играет ключевую роль во многих биологических процессах, таких как функционирование органов и регуляция иммунной системы. Он отличается высокой избирательностью, уничтожая только несущественные клетки и сохраняя те, которые распознают патогены, что позволяет предотвратить аутоиммунные заболевания.
Благодаря этой специфике апоптоз вызывает большой интерес в противораковых терапиях. Традиционные методы лечения, такие как химиотерапия и радиотерапия, поражают как здоровые, так и раковые клетки, что делает их очень «токсичными». Команда Стэнфордского университета предлагает инновационную стратегию, которая использует специфику апоптоза исключительно для поражения раковых клеток.
«Именно этот путь мы хотели выбрать для лечения рака», — объясняет Жеральд Крэбтри, соавтор исследования, опубликованного в журнале Science, в блоге Stanford Medicine. «Мы хотим воспроизвести эту специфику, которая уничтожает 60 миллиардов клеток без сопутствующего ущерба, гарантируя, что ни одна клетка не будет уничтожена, если она не является подходящей мишенью», — добавляет он.
Подход, контрастирующий с традиционной клеточной терапией
Чтобы использовать апоптоз для уничтожения раковых клеток, исследователи разработали небольшую молекулу — химический индуктор близости (CIP). Он действует как молекулярный клей, объединяя и связывая две молекулы, которые в обычных условиях не могли бы соединиться. Гипотеза, выдвинутая командой, заключается в том, что CIP может превратить ингибиторы киназ в активаторы эпигенетически молчаливых транскрипционных состояний. Другими словами, он активирует молекулярный путь, который обычно деактивирован в раковых клетках, в отличие от предыдущих подходов, направленных на деактивацию конкретных онкогенных факторов.
«С тех пор как были открыты онкогены, исследователи пытались нейтрализовать их в раковых клетках», — отмечает Роман Саротт из Стэнфордского медицинского института, также являющийся соавтором исследования. «Вместо этого мы пытаемся использовать их для активации сигнальных систем, которые потенциально полезны для лечения».
Для связи белка BCL6 с протеинкиназой CDK9 был разработан CIP. BCL6, онкогенный белок, вовлечен в 40-60% случаев диффузной крупноклеточной В-лимфомы, часто через мутацию, сверхэкспрессию или дерегуляцию. Мутация BCL6 блокирует апоптоз в раковых клетках, связываясь с генами, отвечающими за этот процесс, и тем самым обеспечивая пролиферацию опухоли. CDK9 активирует эти гены. CIP объединяет эти две молекулы, направляя их к генам-мишеням. «Вы используете элемент, который необходим для выживания рака, чтобы обратить ситуацию вспять и уничтожить его», — объясняет участник исследования Натанаэль Грей.
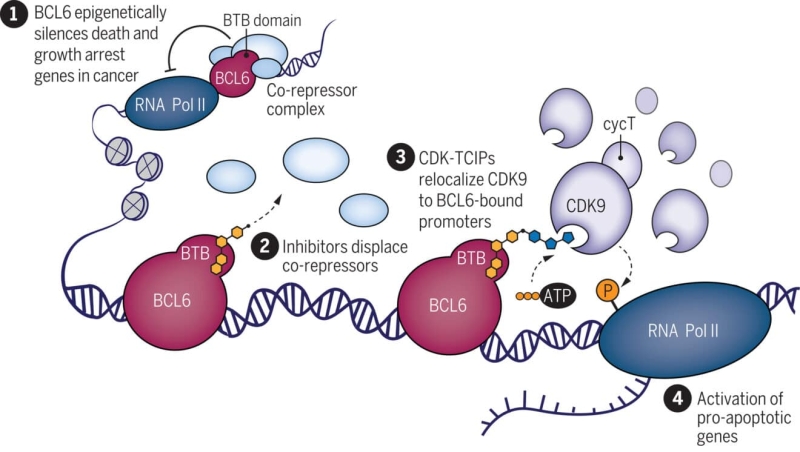
Схема, иллюстрирующая механизм действия молекулярного клея. Транскрипционный фактор BCL6 взаимодействует с эпигенетическими корепрессорами, регулируя клеточную смерть и пролиферацию в лимфоме. Образовавшиеся бивалентные молекулы перенаправляют CDK9 и его активность на участки, регулируемые BCL6, тем самым активируя клеточную смерть.
Стократное увеличение эффективности по сравнению с предыдущими методами лечения
Для выявления наиболее эффективных комплексов CKD9-CIP-BCL6 были проведены испытания на клетках диффузной крупноклеточной В-лимфомы человека. Соединение было протестировано на 859 типах раковых клеток, показав эффективное уничтожение злокачественных клеток. Наиболее эффективные комплексы были в 100 раз эффективнее соединений, нацеленных только на CDK9 или BCL6, при субнаномолярных концентрациях.
Испытания на здоровых мышах не выявили серьезных побочных эффектов. Однако соединение воздействовало и на здоровые B-лимфоциты, поскольку эти иммунные клетки также регулируются BCL6. Соединение оказалось в 200 раз менее токсичным для здоровых B-лимфоцитов, чем для раковых клеток.
Учитывая, что BCL6 регулирует 13 генов, участвующих в апоптозе, эксперты считают, что такая терапия может быть эффективна при раке, устойчивом к лечению. Опухолевые клетки быстро вырабатывают устойчивость к терапии, направленной на один онкогенный фактор. Некоторые методы лечения останавливают рост опухоли, не уничтожая раковые клетки полностью. Команда считает, что если воздействовать на несколько апоптотических путей, то опухоль не сможет выжить достаточно долго для развития резистентности, хотя эту гипотезу еще предстоит проверить.
Следующим шагом станет испытание препарата на мышиных моделях диффузной крупноклеточной В-лимфомы, чтобы собрать доклинические данные для будущих клинических испытаний. Исследователи также планируют изучить другие подобные молекулы, нацеленные на другие онкогенные белки, такие как Ras, который участвует в развитии нескольких форм рака.
Читайте все последние новости здоровья и медицины на New-Science.ru















