Используя улучшенную версию AlphaFold, инструмента искусственного интеллекта для предсказания структуры белков, разработанного Google DeepMind, исследователи выявили комплекс из трех ключевых белков, необходимых для распознавания яйцеклетки и сперматозоида. Считается, что этот тример является общим для всех позвоночных, и его отсутствие неизбежно приводит к неудачному оплодотворению. Это открытие опровергает давнее предположение о том, что для оплодотворения достаточно двух белков, расположенных соответственно на мужской и женской гаметах.
Жизнь каждого полового организма начинается с оплодотворения, в частности со слияния сперматозоида с яйцеклеткой. Мужская гамета движется к яйцеклетке, направляемая химическими сигналами, а затем связывается с ее поверхностью посредством специфических белковых взаимодействий. Это взаимодействие позволяет их мембранам слиться, что приводит к слиянию их генетического материала и формированию зиготы — единственной клетки, которая развивается в эмбрион.
Однако, несмотря на достижения в области визуализации, молекулярные механизмы, управляющие этим взаимодействием, остаются отчасти загадочными. В отличие от большинства клеток половых организмов, которые избегают слияния и сохраняют свою генетическую идентичность, сперматозоид и яйцеклетка специализируются на слиянии. Это включает в себя последовательность точных и высокоспецифичных молекулярных событий, происходящих в основном на уровне их липидных мембран. Эти процессы дискретны и скоротечны, что затрудняет их изучение с помощью стандартных биохимических методов.
Кроме того, сбор и сохранение жизнеспособных яйцеклеток и сперматозоидов у некоторых лабораторных животных, например, у мышей, представляет особую сложность. Поэтому большинство исследований в области репродуктивной биологии сосредоточено на морских беспозвоночных (например, морских ежах), поскольку они могут выделять в воду большое количество жизнеспособных яйцеклеток и сперматозоидов.
Чтобы преодолеть эти трудности, исследователи в новом исследовании сосредоточили свою работу на рыбке Данио-рерио (Danio rerio), позвоночном животном, которое выпускает свои яйцеклетки (или яйца) и сперматозоиды в воду. Чтобы заранее определить возможные взаимодействия между мембранными белками гамет, они воспользовались предсказательной способностью программы AlphaFold, за которую два ее разработчика были удостоены Нобелевской премии по химии в этом году.
ИИ обнаружил ранее не идентифицированный важный белок. «Это уже не старая концепция, когда для открытия двери нужны ключ и замок, все гораздо сложнее», — пояснила журналу Nature Энрика Бьянки из Римского университета Тор Вергата, которая не принимала участия в исследовании.
Идентифицирован дополнительный белок сперматозоидов
За последние 20 лет с помощью генетического скрининга было выявлено несколько белков, необходимых для взаимодействия мужской и женской гамет половых организмов. Izumo1 присутствует в мембране сперматозоида и связывается с Juno, который присутствует на поверхности яйцеклетки во время оплодотворения. Другие белки, структурно схожие с Izumo1 (Spaca6 и Tmem95), присутствуют в мембране сперматозоида, но, по данным предыдущих лабораторных экспериментов, не связываются с Juno.
Сфокусировав свой анализ на белках, связывающих сперматозоиды, команда в новом исследовании использовала AlphaFold Multimer, улучшенную версию AlphaFold, для выявления других потенциальных связывающих белков. «Мы составили список белков, которые, по прогнозам, должны присутствовать на мембране сперматозоида, и провели биоинформационный анализ тысяч прогнозов с помощью AlphaFold Multimer», — объясняет Виктория Денеке, соавтор исследования, в пресс-релизе Научно-исследовательского института молекулярной патологии (IMP).
Алгоритм выявил Tmem81, ранее неизвестный дополнительный белок, который необходим для связывания с Juno. Точнее, Izumo1 и Spaca6 взаимодействуют не только друг с другом, но и с Tmem81, прежде чем смогут связаться с белком яичника. Эти первые результаты демонстрируют важность алгоритмов предсказания и моделирования, когда возможности эмпирической демонстрации ограничены.
Комплекс, сохраняющийся на протяжении всей эволюции позвоночных
Чтобы проверить эти предсказания, исследователи сначала наблюдали за молекулярными процессами оплодотворения у рыб Данио-рерио, затем у мышей и в изолированных клетках человека. Они обнаружили, что тример действительно необходим для оплодотворения во всех моделях.
Комплекс из трех белков прикрепляется к мембране сперматозоида, а два из них образуют участок связывания, позволяющий сперматозоиду состыковаться с яйцеклеткой через Juno у млекопитающих и через аналогичный белок под названием Bouncer у рыб. Другими словами, Juno и Bouncer действуют как замок для доступа к яйцеклетке и открывают доступ только при наличии подходящего «ключа». Более того, без взаимодействия тримеров мужская гамета становится стерильной, и оплодотворение не происходит.
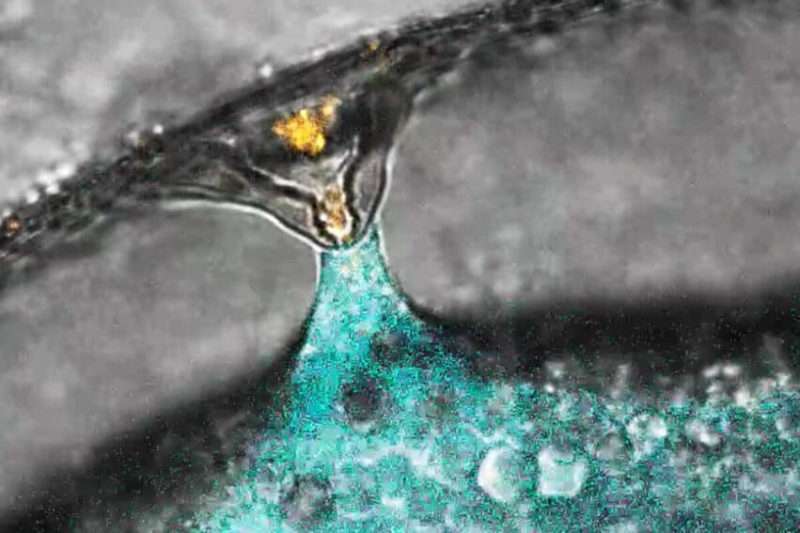
Оплодотворение яйцеклетки Данио-рерио (отмечена синим) сперматозоидом (отмечен оранжевым).
Эти результаты позволяют предположить, что, в отличие от белков яичников, комплекс сперматозоидов Izumo1-Spaca6-Tmem81 является общим для всех позвоночных и сохраняется на протяжении всей их эволюции. Juno, например, появился в результате дупликации фетального рецептора, характерного для млекопитающих, и поэтому присутствует только у них. «Тот факт, что он сохранялся на протяжении миллионов лет эволюции, показывает, насколько важен этот процесс блокировки, но что действительно удивительно, так это то, что сохранившийся тример сперматозоида использует эволюционно неродственные белки яйцеклетки для стыковки с ее поверхностью», — объясняет Андреа Паули из IMP, также являющаяся соавтором исследования.
Это открытие может проложить путь к созданию новых методов скрининга заболеваний, связанных с фертильностью. Понимание этого молекулярного взаимодействия также может потенциально способствовать разработке новых терапевтических вмешательств для лечения бесплодия. Результаты исследования опубликованы в журнале Cell.















