Исследователи обнаружили, что белки тихоходок, экспрессируясь в человеческих клетках, могут замедлять их метаболизм и повышать выживаемость. Этот обратимый процесс вызывает образование геля внутри клеток и запускает биостазис. Эти белки могут проложить путь к новым стратегиям борьбы со старением и помочь усовершенствовать методы сохранения клеток.
Тихоходки (или водяные медведи) — одни из самых живучих организмов на Земле. В среднем менее полумиллиметра в длину, они обладают невероятной способностью выживать в экстремальных условиях. Например, они могут выдерживать температуру от нескольких градусов выше абсолютного нуля до 150 °C, а также уровень радиации, который не выдержит практически ни один живой организм, не говоря уже о невероятной устойчивости в вакууме космоса.
Подобно тихоходкам, ряд других организмов также устойчивы к высыханию. В среде, лишенной воды, они впадают в состояние биостаза (временного прекращения жизненных функций), называемое ангидробиозом. В этом состоянии они полностью приостанавливают свой обмен веществ до регидратации. Ангидробиотические организмы защищают свои клетки от повреждений, вызванных высыханием, накапливая невосстанавливающие сахара, такие как сахароза.
Однако способ, с помощью которого тихоходки выживают при высыхании, особенно интригует. Они накапливают очень мало сахара, если вообще его накапливают. Вместо этого они полагаются на широкий спектр неупорядоченных белков, которые обеспечивают адаптивную защиту от обезвоживания. К ним относятся так называемые «цитоплазматические обильные теплорастворимые» (CAHS) белки.
Однако то, как эти белки запускают биостаз у тихоходок, во многом остается непонятным. В своем новом исследовании, опубликованном в журнале Protein Science, ученые из Университета Вайоминга (США) продолжили изучение процессов, вызываемых этими белками, изучив их воздействие на клетки человека. «Наши результаты открывают путь к разработке технологий, направленных на индуцирование биостазиса в клетках и даже целых организмах для замедления старения и улучшения сохранности и стабильности«, — пояснили они в пресс-релизе.
Гель, вызывающий обратимый биостазис
В новом исследовании ученые сосредоточились на CAHS D — белке CAHS, используемом тихоходкой Hypsibius exemplaris для ангидробиоза. Другие исследования ранее показали, что при экспрессии в дрожжах и бактериях этот белок оказывает защитное действие против повреждений, вызванных высушиванием.
В процессе, приводящем к ангидробиозу, CAHS D переходит из состояния раствора в состояние твердого геля. Было высказано предположение, что такое гелеобразование может играть определенную роль в защитной способности белков CAHS. Однако молекулярные механизмы, лежащие в основе этого гелеобразования, до конца не изучены. Связь между гелеобразованием CAHS и его защитной способностью в значительной степени предположительна, и никаких практических исследований в этой области пока не проводилось.
Чтобы изучить этот вопрос, специалисты из Университета Вайоминга проанализировали структуру гидрогелей CAHS D с помощью сканирующей электронной микроскопии (СЭМ) и малоуглового рассеяния рентгеновских лучей (МРРЛ) — аналитического метода, который измеряет интенсивность рентгеновских лучей, рассеиваемых образцом, в зависимости от угла рассеяния. Для анализа молекулярных взаимодействий, приводящих к гелеобразованию, исследователи объединили вычислительный и биофизический подходы.
Они обнаружили, что гидрогели CAHS D состоят из переплетенной сети волокон длиной около 10 нанометров. Переход в гелеобразное состояние вызывается изменением концентрации жидкой среды и температуры. Это вызывает осмотический стресс, после которого белок накапливается во все более плотных волокнистых скоплениях, пока не образует цитоскелетоподобный узел. Гелеобразование белков ограничивает движение молекул, а также биологических материалов, чувствительных к обезвоживанию.
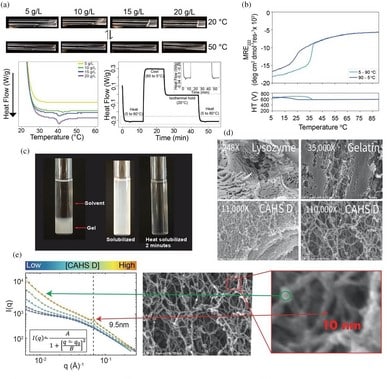
Белок CAHS D образует гель, который иммобилизует и стабилизирует биологический материал in vitro. (a) Концентрационная и температурная зависимость гелеобразования CAHS D. (b) Термическая денатурация и охлаждение структуры белка CAHS D. (c) Разбавление 10 г/л (0,4 мМ) геля CAHS D в 20 мМ Трис-буфере приводит к разрешению примерно за 2 минуты при 55 °C. (d) СЭМ-изображения лизоцима (фермента), желатина и CAHS D. Ретикулярные гели CAHS D похожи на белок желатина, но отличаются от гелей лизоцима — негелевого белка. (e) Зондирование гелей CAHS D при различных концентрациях выявило появление структуры размером около 9,5 нм. На увеличенном СЭМ-изображении в области красной подписи показано волокно шириной около 10 нм, что хорошо соответствует пику, возникающему при увеличении концентрации на графике МРРЛ (показан красной стрелкой и черной пунктирной линией). Зеленая стрелка подчеркивает изменение внутреннего пустотного пространства в пределах одного волокна.
В ходе испытаний на человеческих клетках выяснилось, что фибрилла CAHS D индуцирует защиту от осмотического стресса, вызывая устойчивость к изменению объема и замедляя метаболизм. «Удивительно, но когда мы вводим эти белки в клетки человека, они образуют гель и замедляют метаболизм, как у тихоходок«, — объясняет Сильвия Санчес-Мартинес из Университета Вайоминга, ведущий автор исследования. «Более того, как и тихоходки, человеческие клетки, содержащие эти белки в биостазе, становятся более устойчивыми к стрессу, наделяя некоторые способности тихоходок«, — добавляет она.
Замедление метаболизма, вызванное гелеобразованием CAHS D, тесно коррелировало с улучшением выживаемости клеток. Более того, конденсация белка, а также индуцированные эффекты обратимы при возвращении к нормальным осмотическим условиям. «Когда стресс снимается, гели тихоходок растворяются, и клетки человека возобновляют нормальный метаболизм«, — объясняет Томас Бутби, один из авторов исследования и научный сотрудник Университета Вайоминга.
Эти результаты обещают широкие перспективы применения белков тихоходок, таких как стратегии замедления старения и хранения стволовых клеток для клеточной терапии. Предыдущие исследования, проведенные той же командой, показали, что природные и искусственные версии белков тихоходок можно использовать для стабилизации незаменимого соединения для лечения гемофилии, не требуя охлаждения.















